Elektrol�za - fyzik�ln� z�klady |
| Obsah >>> |
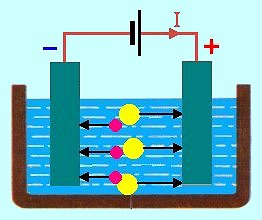
Jestli�e do elektrolytu vlo��me dv� kovov� elektrody a p�ipoj�me je ke svork�m vn�j��ho stejnosm�rn�ho zdroje nap�t�, vznikne uvnit� elektrolytu mezi elektrodami elektrick� pole, kter� vyvol� usm�rn�n� pohyb iont� v roztoku. Kladn� ionty (kationty) se za�nou pohybovat ke katod� (elektrod� p�ipojen� k z�porn� svorce zdroje), z�porn� ionty (anionty) se pohybuj� k anod� (elektrod� p�ipojen� ke kladn� svorce zdroje). P�i pr�chodu elektrick�ho proudu elektrolytem doch�z� - na rozd�l od kovov�ho vodi�e - k p�enosu l�tky.
Chemick� zm�ny, kter� prob�haj� na elektrod�ch pr�chodem proudu, je mo�no v praxi vyu��t r�zn�m zp�sobem. P�i elektrol�ze se na katod� vylu�uje vod�k nebo kov. Z toho vypl�v� z�kladn� sestava pro pokovov�n�:
Na lev�m obr�zku je p��klad veden� proudu v roztoku kuchy�sk� soli NaCl. Z�porn� ionty chloru (na obr. �lut�) sm��uj� k anod�, kladn� ionty sod�ku (na obr. fialov�) ke katod�.
- katoda - vodiv� p�edm�t, kter� m� b�t pokovov�n
- anoda - elektroda z kovu, kter�m se pokovuje
- elektrolyt - roztok soli kovu, kter�m se pokovuje
P��klad pokovov�n� (galvanizace):
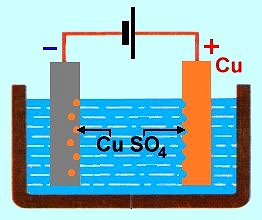
�elezn� p�edm�t chceme pokr�t tenkou vrstvi�kou m�di. Jako anodu pou�ijeme kus m�di, pokovovan� p�edm�t bude katodou a elektrolytem bude roztok nap�. s�ranu m��nat�ho CuSO4. Situace je sch�maticky zn�zorn�na na prav�m obr�zku. Po p�ipojen� ke zdroji nap�t� se kladn� ionty m�di budou usazovat na povrchu z�porn� katody, z�porn� ionty SO4 budou sm��ovat k anod�, reagovat na n� s atomy m�di a jako molekuly CuSO4 se budou vracet zp�t do elektrolytu. Katoda se bude pokr�vat m�d�, anody bude ub�vat a koncentrace CuSO4 v elektrolytu z�stane stejn�. M�� bude prost�ednictv�m elektrolytu p�ech�zet z anody na katodu.
Uspo��dan� pohyb iont� v elektrolytu kon�� na elektrod�ch, kde ionty odevzd�vaj� n�boje. Podle druhu iont� a materi�lu elektrod m��e po odevzd�n� n�boje nastat n�kter� z t�chto mo�nost�:
- ionty se usazuj� na povrchu elektrod jako atomy nebo molekuly, vytv��ej� na nich povlak
- ionty se vylu�uj� jako atomy nebo molekuly plynu a unikaj� ve form� bublin z elektrolytu ven
- ionty chemicky reaguj� s materi�lem elektrody
- ionty reaguj� s elektrolytem a vrac� se do n�j zp�t
D�j, p�i kter�m pr�chodem elektrick�ho proudu elektrolytem doch�z� k l�tkov�m zm�n�m, naz�v�me ELEKTROL�ZA.
Podle dohody je sm�r proudu ur�en sm�rem pohybu kladn�ch iont�.
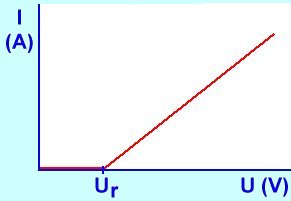
Trval� proud v elektrolytu vznik�, jestli�e p�ipojen� nap�t� p�ekro�� hodnotu tzv. rozkladn�ho nap�t� Ur. P�i dal��m zv�t�ov�n� nap�t� pak proud I roste line�rn�:
U = Ur + R.I kde R se naz�v� odpor elektrolytu. Jde o ur�itou obdobu Ohmova z�kona, jak ho zn�me v p��pad� veden� proudu v kovov�ch vodi��ch.
Vznik rozkladn�ho nap�t� Ur souvis� s d�ji prob�haj�c�mi na elektrod�ch (viz v��e). S rostouc� teplotou se ionty v elektrick�m poli pohybuj� rychleji, odpor elektrolytu kles� a proto elektrick� proud roste.
V�sledky elektrol�zy dan�ho roztoku z�vis� na materi�lu, z n�ho� jsou elektrody. P�i elektrol�ze se na katod� v�dy vylu�uje vod�k nebo kov. Veden� elektrick�ho proudu v elektrolytech studoval anglick� fyzik Michael Faraday. V�sledky sv�ch experiment�ln�ch v�zkum� shrnul do dvou z�kon�:
1. Faraday�v z�kon
Hmotnost l�tek vylou�en�ch na elektrod�ch je p��mo �m�rn� celkov�mu elektrick�mu n�boji, kter� p�enesly ionty p�i elektrol�ze.
Jin�mi slovy: Hmotnost l�tek vylou�en�ch na elektrod�ch je t�m v�t��, ��m v�t�� je proch�zej�c� proud a ��m del�� dobu proud proch�z�.
m = A.Q m = A.I.t
kde A je konstanta �m�rnosti a naz�v� se elektrochemick� ekvivalent l�tky
2. Faraday�v z�kon
L�tkov� mno�stv� r�zn�ch l�tek vylou�en�ch p�i elektrol�ze t�m� n�bojem jsou chemicky ekvivalentn�.
Elektrochemick� ekvivalent je konstanta charakterizuj�c� l�tky, kter� se vylu�uj� na elektrod�ch p�i elektrol�ze. Ud�v�, kolik l�tky v kg se vylou�� na elektrod�ch elektrick�m n�bojem o velikosti 1 coulomb (tento n�boj p�enese nap��klad proud o velikosti 1 A za 1 sekundu). Velikost elektrochemick�ho ekvivalentu pro r�zn� l�tky najdeme v tabulk�ch. Nap��klad elektrochemick� ekvivalent m�di je 0,33.10-6 kg/C.