Úvodní stránka
Jak září atomy
Vznik světla objasňuje kvantová teorie. Atomy nemohou mít jakoukoli energii, ale mohou se vyskytovat jen v určitých energetických stavech, na určitých energetických hladinách. V základním stavu má atom nejnižší energii. Jestliže atomu dodáme dostatečnou energii (např. zahřátím nebo ozářením), přejde z nižší energetické hladiny na vyšší, dojde k jeho excitaci neboli vybuzení. V excitovaném stavu však zůstává jen velmi krátkou dobu (řádově 10-8 s) a po vyzáření jednoho nebo několika fotonů se vrací do základního stavu.
Poznámka:
Jednotkou energie je joule (J), ale tato jednotka je pro popis dějů v atomech příliš velká. Proto se v atomistice energie udává v jednotkách mnohem menších, v elektronvoltech (eV). 1 eV je energie, kterou získá elektron, projde-li mezi dvěma místy elektrického pole s napětím 1 V. Většími jednotkami jsou kiloelektronvolt (1 keV = 1 000 eV) a megaelektronvolt (1 MeV = 1 000 000 eV).
Platí převodní vztah 1 eV = 1,6.10-19 J.
Pro názornost si ukážeme, jaké fotony mohou vyzařovat atomy nejjednoduššího prvku, vodíku. Z kvantové teorie víme, že energie fotonu je Ef = h.c/l a pro vlnovou délku platí l = c/f. Z Bohrovy teorie plyne pro první čtyři energetické hladiny atomu vodíku:
| Energetická hladina
|
E1
|
E2
|
E3
|
E4
|
| Energie (eV)
|
0
|
10,15
|
12,03
|
12,68
|
| Energie (J)
|
0
|
16,24.10-19
|
19,25.10-19
|
20,29.10-19
|
Mezi jednotlivými hladinami přecházejí atomy zcela náhodně, velikost vyzářené energie a tím i vlnovou délku vzniklých fotonů udává následující tabulka:
| Přechod
|
Rozdíl energií
(eV)
|
Rozdíl energií
(J)
|
vlnová délka
(nm)
|
Poznámka
|
| E4 - E1
|
12,68
|
20,29.10-19
|
98
|
ultrafialové
|
| E4 - E2
|
2,53
|
4,05.10-19
|
489
|
modrozelené
|
| E4 - E3
|
0,65
|
1,04.10-19
|
1904
|
infračervené
|
| E3 - E1
|
12,03
|
19,25.10-19
|
103
|
ultrafialové
|
| E3 - E2
|
1,88
|
3,01.10-19
|
658
|
červené
|
| E2 - E1
|
10,15
|
16,24.10-19
|
122
|
ultrafialové
|
Jestliže například vybudíme atom vodíku ze základního stavu E1 na čtvrtou energetickou hladinu E4, může se vrátit do základního stavu některým ze čtyř způsobů. Atom při nich může vyzářit 1, 2 nebo 3 fotony:
| Přechody
|
Vlnové délky fotonů (nm)
|
| E4 - E3 E3 - E2 E2 - E1
|
1904 658 122
|
| E4 - E3 E3 - E1
|
1904 103
|
| E4 - E2 E2 - E1
|
489 122
|
| E4 - E1
|
98
|
Látka však není tvořena jediným atomem. Je jich nepředstavitelně velké množství, takže při návratu vybuzených atomů si každý atom „vybere“ některou z uvedených možností a jako celek vyzařuje vodík fotony všech vlnových délek (barev), uvedených v tabulce. Záření všech vyzařovaných vlnových délek tvoří spektrum tvořené spektrálními čarami. Ve viditelné části vodíkového spektra jsou jen 4 spektrální čáry.
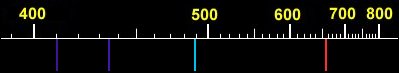 Spektra složitějších atomů se skládají z mnohem většího počtu spektrálních čar než spektrum vodíku. Jejich vlnové délky se už také nedají určit tak snadno jako u vodíku. Pouhým okem však jednotlivé barvy ve spektru rozlišit nemůžeme, oko z nich vytvoří jakousi výslednou barvu. Ke studiu spektra je třeba rozložit světlo spektroskopem.
Spektra složitějších atomů se skládají z mnohem většího počtu spektrálních čar než spektrum vodíku. Jejich vlnové délky se už také nedají určit tak snadno jako u vodíku. Pouhým okem však jednotlivé barvy ve spektru rozlišit nemůžeme, oko z nich vytvoří jakousi výslednou barvu. Ke studiu spektra je třeba rozložit světlo spektroskopem.
|