Úvodní stránka
Z čeho se skládá atom
I když pojem „atom“ pochází už z 5. století př. n. l., začaly první výzkumy složení látek teprve v 18. století a základy atomové fyziky vznikly teprve na konci 19. století. Připomeňte si několik pojmů, které najdete v různých souvislostech na stránkách tohoto materiálu.
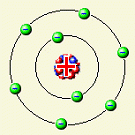 Látky jsou složeny z atomů, v různých skupenstvích je uspořádání různé. Každý atom se skládá z atomového obalu a jádra. Obal je tvořen určitým počtem záporných elektronů, které si (velmi zjednodušeně) můžeme představit jako nepatrné kuličky „obíhající“ kolem kladného jádra. Jádro je složeno ze dvou druhů částic - kladně nabitých protonů a elektricky neutrálních neutronů. Náboje elektronu a protonu se liší jen znaménkem. Jejich velikost je stejná: e = 1,6.10-19 C. Za normálních okolností je počet elektronů v obalu stejný jako počet protonů v jádře - atom je navenek elektricky neutrální. Látky jsou složeny z atomů, v různých skupenstvích je uspořádání různé. Každý atom se skládá z atomového obalu a jádra. Obal je tvořen určitým počtem záporných elektronů, které si (velmi zjednodušeně) můžeme představit jako nepatrné kuličky „obíhající“ kolem kladného jádra. Jádro je složeno ze dvou druhů částic - kladně nabitých protonů a elektricky neutrálních neutronů. Náboje elektronu a protonu se liší jen znaménkem. Jejich velikost je stejná: e = 1,6.10-19 C. Za normálních okolností je počet elektronů v obalu stejný jako počet protonů v jádře - atom je navenek elektricky neutrální.
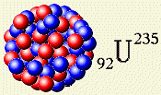 Jádro zaujímá jen nepatrnou část objemu atomu, ale je v něm soustředěna prakticky veškerá hmotnost atomu. Protony a neutrony mají téměř stejnou hmotnost, která je téměř 2000x větší než hmotnost elektronu. Protony a neutrony se označují společným názvem nukleony. Jádra atomů se charakterizují dvěma čísly, která se používají v zápisu značek chemických prvků: Jádro zaujímá jen nepatrnou část objemu atomu, ale je v něm soustředěna prakticky veškerá hmotnost atomu. Protony a neutrony mají téměř stejnou hmotnost, která je téměř 2000x větší než hmotnost elektronu. Protony a neutrony se označují společným názvem nukleony. Jádra atomů se charakterizují dvěma čísly, která se používají v zápisu značek chemických prvků:
• protonové (atomové) číslo Z - je rovno počtu protonů v jádře, udává také počet elektronů obíhajících kolem jádra a pořadí prvku v Mendělejevově periodické tabulce
• nukleonové (hmotnostní) číslo A - je rovno součtu protonů a neutronů v jádře
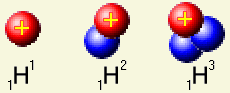 Atom určitého chemického prvku má (podle pořadí prvku v Mendělejevově tabulce) v obalu určitý počet elektronů a v jádře stejný počet protonů. Atomy téhož prvku se však mohou lišit počtem neutronů v jádře. Určitý prvek může být „směsí“ několika druhů jader - všechna mají stejný počet protonů, ale liší se počtem neutronů. Prvek může mít několik izotopů. Na obrázku jsou jádra tří izotopů vodíku. Atom určitého chemického prvku má (podle pořadí prvku v Mendělejevově tabulce) v obalu určitý počet elektronů a v jádře stejný počet protonů. Atomy téhož prvku se však mohou lišit počtem neutronů v jádře. Určitý prvek může být „směsí“ několika druhů jader - všechna mají stejný počet protonů, ale liší se počtem neutronů. Prvek může mít několik izotopů. Na obrázku jsou jádra tří izotopů vodíku.
Různé izotopy téhož prvku mají stejné chemické vlastnosti, ale mohou mít velmi rozdílné vlastnosti fyzikální. Některé mohou být např. stabilní, jiné jsou radioaktivní. Izotopy téhož prvku se dají rozlišit nebo oddělit jen fyzikálními metodami, například působením elektrického nebo magnetického pole.
Působí-li na atom dostatečně velká energie (např. zahřívání, ozáření, silné elektrické pole), může se z jeho obalu odtrhnout jeden nebo více elektronů. Dojde k ionizaci atomu. Odtržený elektron sebou odnáší záporný náboj, je to záporný iont. „Zbytek“ atomu má přebytek kladných nábojů a stává se kladným iontem. Ionizace atomů zářením nebo nabitými částicemi je jednou ze základních metod detekce ionizujícího záření.
| Částice |
Hmotnost (kg) |
El. náboj (C) |
Objev |
| elektron |
9,1.10-31 |
- 1,6.10-19 (-e) |
J. J. Thomson, 1897 |
| proton |
1,67.10-27 |
+ 1,6.10-19 (+e) |
E. Rutherford, 1913 |
| neutron |
1,67.10-27 |
0 |
J. Chadwick, 1932 |
| pozitron |
9,1.10-31 |
+ 1,6.10-19 (+e) |
P. A. M. Dirac, 1928 |
| foton |
0 |
0 |
A. Einstein, 1905 |
|