Galvanick� �l�nky - fyzik�ln� z�klady |
| Obsah >>> |
V roce 1800 se za�ala ps�t nov� historie elekt�iny - Alessandro Volta sestrojil galvanick� �l�nek, prvn� st�l� zdroj elektrick�ho proudu. Funkce galvanick�ho �l�nku spo��v� v p�em�n� chemick� energie na elektrickou energii. Galvanick� �l�nky se d�l� na prim�rn� a sekund�rn� (akumul�tory).
Prim�rn� �l�nky n�m poskytuj� velmi drahou energii, proto�e jsou jen "na jedno pou�it�". Po vybit� se st�vaj� nebezpe�n�m odpadem, kter� je zna�nou z�t�� pro �ivotn� prost�ed�. V�hodn�j�� jsou proto sekund�rn� �l�nky - akumul�tory, kter� se mohou mnohokr�t opakovan� vyb�jet a nab�jet.
Prim�rn� �l�nky
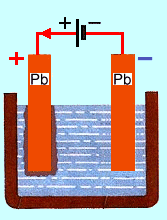
Nejjednodu��� galvanick� �l�nek se skl�d� z elektrolytu a dvou elektrod. Elektrolytem je z�ed�n� kyselina s�rov�, kladn� elektroda je z m�di a z�porn� elektroda je zinkov�. Molekuly vody rozru�uj� vazbu atom� v molekul�ch kyseliny, kter� se roz�t�p� na kladn� a z�porn� ionty. Tomuto jevu se ��k� disociace.
Pono�en�m elektrod do elektrolytu se zinkov� elektroda za�ne rozpou�t�t a do elektrolytu se dost�vaj� kladn� ionty zinku. V elektrod� z�stanou voln� elektrony a proto se zinkov� elektroda nab�j� z�porn�. M�� se v roztoku kyseliny rozpou�t� m�n� ne� zinek a proto je "m�n� z�porn�" ne� zinkov� elektroda - je v��i n� kladn�. Mezi ob�ma elektrodami se objev� nap�t� o velikosti 1,05 V.
Jestli�e p�ipoj�me k elektrod�m spot�ebi� (nap�. ��rovku), p�ech�zej� nadbyte�n� elektrony ze zinkov� elektrody p�es spot�ebi� k m�d�n� elektrod� a ��st jejich energie se ve spot�ebi�i m�n� nap��klad na sv�tlo nebo teplo. Obvodem za�ne proch�zet elektrick� proud: ve vn�j��m obvodu je zp�soben pohybem voln�ch elektron� v kovov�ch vodi��ch, v elektrolytu pohybem kladn�ch a z�porn�ch iont�. Na elektrod�ch p�itom doch�z� k chemick�m reakc�m a jejich zplodiny by brzy pokryly povrch elektrod a �l�nek by se brzy znehodnotil. Tento nep��zniv� jev se odstra�uje depolariz�torem, kter� zabra�uje usazov�n� zplodin na elektrod�ch.
Nejpou��van�j�� jsou tzv. such� �l�nky Leclanch�ovy - kladnou elektrodou je uhl�kov� ty�inka, z�pornou je zinkov� kal�ek, elektrolytem je pasta chloridu amonn�ho a depolariz�torem sm�s oxidu mangani�it�ho a grafitu. Nap�t� mezi elektrodami je 1,5 V. V�konn�j��, ale dra��� jsou �l�nky alkalick� nebo rtu�ov�. Pot�ebujeme-li v�t�� nap�t�, spojujeme jednotliv� �l�nky s�riov� a vytvo��me z nich baterii �l�nk�, nap��klad b�n� ploch� baterie s nap�t�m 4,5 V je tvo�ena t�emi s�riov� zapojen�mi �l�nky (4,5 V = 3 x 1,5 V).
Pou�it� prim�rn�ch �l�nk� je velmi �irok�, nap��klad v kapesn�ch sv�tiln�ch, mal�ch rozhlasov�ch p�ij�ma��ch, hra�k�ch, magnetofonech, hodink�ch atd.
Akumul�tory
Prvn� akumul�tor s olov�n�mi elektrodami navrhnul roku 1859 francouzsk� chemik Plant�, po dal��m v�voji a zdokonalen� se tento typ akumul�tor� za�al pou��vat od roku 1868. V roce 1899 vyvinul Junger akumul�tor s niklovou a kadmiovou elektrodou, kter� dnes zn�me pod ozna�en�m NiCd. Po dvou letech p�i�el Edison s patentem na akumul�tor s niklovou a �eleznou elektrodou, tzv. NiFe akumul�tor. Tento typ elektrochemick�ch �l�nk� shroma��uje - akumuluje - elektrickou energii tak, �e se nejprve mus� nab�t. P�i nab�jen� (obr�zek vlevo) dod�v�me elektrickou energii, kter� se prob�haj�c�mi reakcemi mezi elektrolytem a elektrodami m�n� na energii chemickou. P�i vyb�jen� (uka� my�� na AKUMUL�TOR) se chemick� energie m�n� op�t na elektrickou, kter� nap�j� n�jak� spot�ebi�. Cyklus nab�jen� a vyb�jen� akumul�toru se m��e mnohokr�t opakovat.
Nejstar��m a dodnes nejpou��van�j��m typem je akumul�tor olov�n� s nap�t�m 1,85 - 2,1 V (elektrody jsou z olova, elektrolytem je z�ed�n� kyselina s�rov�). Stav akumul�toru se zji��uje m��en�m hustoty elektrolytu nebo svorkov�ho nap�t� p�i zat�en�. Olov�n� akumul�tor je n�ro�n� na �dr�bu a mus� se udr�ovat v nabit�m stavu. P�i n�zk�ch teplot�ch kles� jeho kapacita, nap��klad p�i teplot� -20�C se zmen�� jeho kapacita na pouhou �tvrtinu.
Pou�it� akumul�tor� je velmi �irok�: od automobil� p�es elektrick� voz�ky a� po sv�tilny, hra�ky nebo mobiln� telefony. Nejpou��van�j��mi jsou akumul�tory olov�n�, niklo�elezov� (NiFe), niklokadmiov� (NiCd), st��brokadmiov�, st��brozinkov�.
- AKUMUL�TOR -
animace (uka� my��)
Z�kladn� pojmy
- Kapacita �l�nku - sou�in vyb�jec�ho proudu a celkov� doby vyb�jen�, ud�v� se v amp�rhodin�ch (Ah). Nap��klad kapacita automobilov�ho akumul�toru 40 Ah znamen�, �e akumul�tor se m��e proudem 1 A vyb�jet po dobu 20 h, proudem 2 A se m��e vyb�jet 10 h atd.
- Elektromotorick� nap�t� - nap�t� nezat�en�ho �l�nku, tj. �l�nku, ke kter�mu nen� p�ipojen� ��dn� spot�ebi�
- Vnit�n� odpor - odpor vnit�n�ch vodiv�ch ��st� galvanick�ho �l�nku (elektrody, elektrolyt), vnit�n� odpor �l�nku se p�i odb�ru proudu postupn� zv�t�uje, �l�nek se vyb�j�
- Svorkov� nap�t� - nap�t� zat�en�ho �l�nku, je v�dy men�� ne� elektromotorick� nap�t�. Rozd�l mezi svorkov�m a elektromotorick�m nap�t�m je t�m v�t��, ��m v�t�� je odeb�ran� proud a ��m v�t�� je vnit�n� odpor (tj. ��m vy�erpan�j�� je �l�nek)
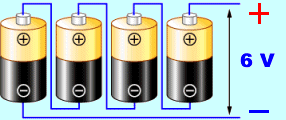
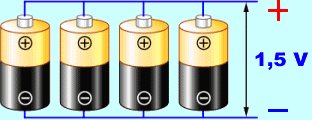
- Zapojen� �l�nk� - p�i s�riov�m zapojen� (obr�zek vlevo) je celkov� nap�t� sou�tem nap�t� jednotliv�ch �l�nk�, ale vnit�n� odpor baterie je v�t��. Paraleln� zapojen� (obr�zek vpravo) se pou��v� v p��pad�, �e je t�eba v�t�� odb�r proudu ze zdroje - p�i paraleln�m zapojen� je men�� vnit�n� odpor zdroje.